いよいよ熱力学が嫌いになるエンタルピー、エントロピーに突入です。
まずは、エンタルピーからです。
目次
エンタルピー変化の実例
反応エンタルピー
生成エンタルピー
ヘスの法則
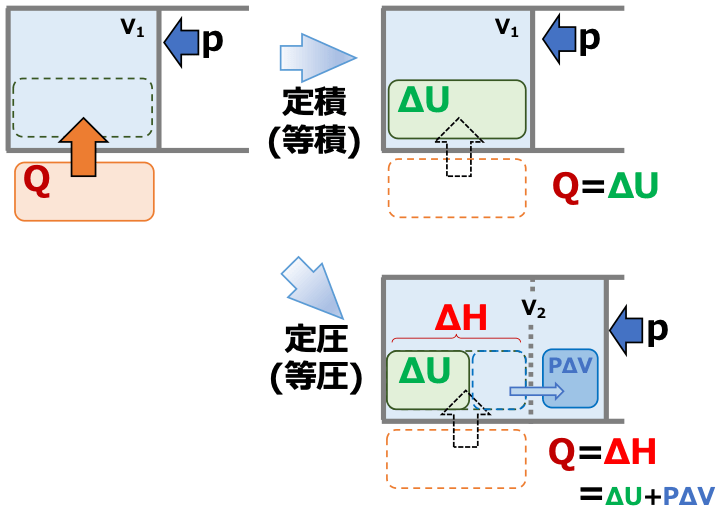
等積変化では \(\tiny \Delta U = Q \) であり、系に出入りする熱Qは状態量の変化量である内部エネルギー変化ΔUとして表すことができます。
しかし、実用的な系の多くは等圧下である場合が多く、等圧変化においてエネルギーの変化量を表すことのできる状態量が欲しい、ということになります。
そこで、状態量として、次のエンタルピーHを導入します。
\(\scriptsize H = U + PV \)
等圧変化の前後(状態1→状態2)のエンタルピーの変化は
\(\scriptsize \color{red}{\Delta H } \color{}{= (U_2 + PV_2) – (U_1 + PV_1)} \)
\(\scriptsize = (U_2 -U_1)+ P(V_2 – V_1) \)
\(\scriptsize = \Delta U + P \Delta V \)
\(\scriptsize = (Q+W) -W \)
\(\scriptsize \color{red}{= Q} \)
となり、等圧変化の過程においては系に出入りする熱量がエンタルピーの変化量に等しくなることがわかり、熱量の出入りを状態量の変化で表すことができます。
なお、ここで重要なことですが、エンタルピーは状態量なので反応前後の状態のみで決まり、途中経路によらない、ということです。エンタルピーについては(反応途中で系と外界との圧力の平衡状態が崩れていたとしても)最終的に安定した状態で圧力が最初と同じであれば問題ない、ということになります。
エンタルピーの定義はわかったものの、何のためにわざわざそんなものを導入したのかピンとこないと思います。実際にエンタルピーはどのように使われているかをみていきます。
化学反応にともなって発生する(または吸収する)熱量について、高校化学では「反応熱」という言葉をもちいて「熱化学方程式」にて表現していました。また、反応熱のなかでも、燃焼反応による発熱量を「燃焼熱」、中和反応にともなう発熱量を「中和熱」、溶解にともなう発熱・吸熱量を「溶解熱」と呼びます。
これらは実はエンタルピー変化のひとつであり、「反応エンタルピー変化」\( \scriptsize\color{red}{ \Delta_{r}{H} } \) になります(定圧条件下の反応において系に出入りする熱であることから)。単位は J(kJ) です。
注意が必要なのは、「反応熱」は反応によって発熱する場合に正の値としていましたが、エンタルピー変化で表す場合は、発熱反応では系から熱が放出されていくために負(ΔrH<0)となります。ΔrH = H(反応後) – H(反応前) = H(生成系) – H(反応系) であることを考えれば間違えないでしょう。
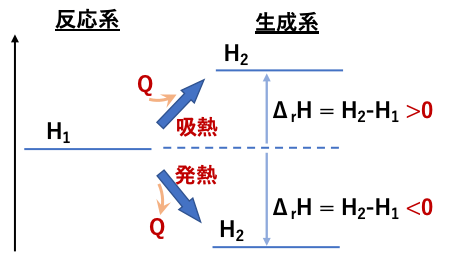
「エネルギー図」と呼んでいたものは実は「エンタルピー図」であり、縦軸はエネルギーではなくエンタルピーを示します(単体のエンタルピーを基準として、反応物質を構成する分子を生成するための変化量を示すので、正しくはエンタルピー変化というべきなのかもしれないですが)。
※なお、2022年以降、日本の教科書から熱化学方程式が消えて、エンタルピー変化による説明に改訂されるそうです。
25℃、1barの「標準状態」条件において、分子の構成元素の単体から、その分子1molを生成させる場合の反応エンタルピーを標準生成エンタルピーといい、\( \scriptsize \color{red}{\Delta _{f}{H}^{\circ}} \) と表します。\( \scriptsize f \) は「生成」formationを、\( \scriptsize ^{\circ}\) は標準状態を表しています 。単位は J mol-1(kJ mol-1) です。
単体の標準生成エンタルピーはゼロです。
話がまた、反応エンタルピーに戻ります(ややこしいですが)。
反応エンタルピーは、単位が J であり、示量性です。反応する物質の量が2倍になれば、反応エンタルピーも2倍になります。
一方、25℃、1barの「標準状態」条件において、反応が1mol分進行(反応進行度 \(\scriptsize \xi \) )した場合の反応エンタルピーを標準反応エンタルピーといい、\( \scriptsize \color{red}{\Delta _{r}{H}^{\circ}} \) と表します。\( \scriptsize r \) は「反応」reactionを、\( \scriptsize ^{\circ}\) は標準状態を表しています 。単位は J mol-1(kJ mol-1) です。
標準状態の定義は、圧力に関して二通りあります。
圧力 ① 1 atm(101.325 kPa) ② 1 bar(105 Pa = 100 kPa)
IUPACは後者(いずれもほぼ1気圧であることには変わりないが)
温度については規定はなく、文献や使用時ごとに異なるため、都度確認が必要。25℃(298.15 K)をもちいることが多い。
「化学反応に伴い生成または吸収する熱(反応熱)は反応のはじめと終りの状態のみで決まり、途中の経路には関係しない」
これをエンタルピー変化の図で示すと、下のような例になります。
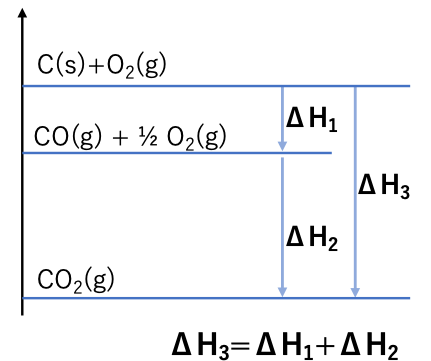
ヘスの法則をもちいることによって、反応自体やその熱量測定を実際にはおこなっていない反応についても、既知の反応を組み合わせて計算することによって、反応の熱量を求めることができます。
有機化合物の標準生成エンタルピーも、一般に、反応エンタルピー(特に標準燃焼熱)の測定によって求められます。
※実際には、ヘスの法則はエンタルピーの概念がまだない時代に見い出されましたが、状態量であるエンタルピーの概念が登場したことによって、後追いで正当性が示されました。
